

01 | 研究背景
心血管疾病(CVD)是全球范圍內威脅人類生命健康的最主要的慢性非傳染性疾病,動脈粥樣硬化性心血管疾病(ASCVD)為主的CVD(如缺血性心臟病和缺血性腦卒中等)是我國城鄉居民第1位死亡原因,占死因構成的40%以上[1]。低密度脂蛋白膽固醇(LDL-C)升高是公認的CVD獨立危險因素,由于他汀類藥物能夠有效降低LDL-C水平及心血管事件風險,現已成為防治CVD的基石。然而,經包括他汀類藥物治療使LDL-C達標在內的傳統危險因素管理后,患者仍存在發生大血管或微血管事件的風險,即CVD殘余風險。近年來多項流行病學、機制以及人群干預等研究提示,甘油三酯(TG)水平升高與CVD存在一定關聯,是他汀類藥物治療后CVD殘余風險的重要因素[2]。二十碳五烯酸乙酯是一種ω-3多不飽和脂肪酸,能夠抑制壞脂蛋白的作用,減少在血管內壁上的附著沉積,而且能協助高密度脂蛋白膽固醇(HDL-C)清除血管壁上多余的脂肪。2012年7月26日,美國食品與藥物管理局(FDA)批準Amarin制藥公司的二十碳五烯酸乙酯軟膠囊(商品名:Vascepa)用于治療高甘油三酯血癥,成為市場上第二個ω-3多不飽和脂肪酸處方藥。同時,二十碳五烯酸乙酯是FDA批準的唯一一個最大耐受劑量他汀類藥物的輔助用藥以及首個獲批能有效降低殘余心血管事件發生風險的藥物。
02| 品種基本情況

參考FDA于2022年11月修訂發布的《二十碳五烯酸乙酯軟膠囊生物等效性研究指導意見(草案)》,推薦了兩種類型研究:第一種是體外試驗;第二種是以PK參數為終點評價指標的BE研究。下文將結合個藥指南對本品生物等效性研究的關鍵點進行分析[3]。
1. 研究類型
FDA個藥指南建議采用部分重復或完全重復交叉設計,以4g的單次給藥劑量進行空腹和餐后給藥條件下的生物等效性研究。
二十碳五烯酸乙酯為二十碳五烯酸(EPA)的前體藥物,口服后被酯酶迅速水解為EPA,EPA水溶性較差,其吸收依賴膽固醇、磷脂等膽鹽乳化后形成可溶性膠束被小腸上皮細胞攝取進入體循環吸收。文獻報道EPA個體內變異可達60%[4],相比于餐后試驗,空腹條件下參與乳化的膽鹽更少導致吸收較差,個體內變異更高。因此重復交叉設計符合本品生物等效性評價目的,可降低試驗失敗風險。
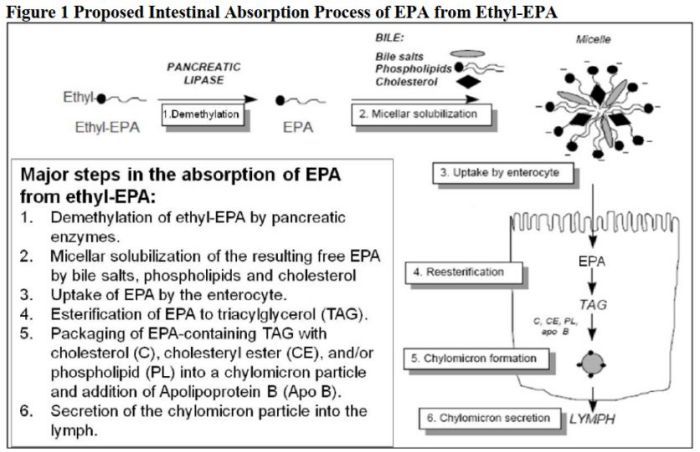

根據原研說明書,本品在給藥后約5小時達到血漿峰濃度,文獻數據顯示,個體達峰時間范圍在7-36小時,整體吸收較為平緩,可在達峰時間附近稍密集采血。平均半衰期約89小時,采血至給藥后288小時滿足不少于3個半衰期要求。此外,根據FDA個藥指南要求,還需要從給藥前24小時至0小時(含0小時)之間收集三個或更多(>3個)樣本,以這些點的平均血藥濃度值來計算基線值并進行扣除。
3. 檢測物質
循環系統中血漿內大部分EPA參與構成磷脂、甘油三酯、膽固醇酯,小于1%以未酯化的脂肪酸形式存在。FDA個藥指南推薦對血漿中的總EPA和游離EPA血藥濃度進行測定,因此本品的檢測物質為血漿中的總EPA和游離EPA。
4. 生物等效性評價
以基線校正后的總EPA作為本品生物等效性評價的指標,提交基線校正后的游離EPA結果作為支持性數據。對于適用RSABE(即參比制劑的個體內變異CVw≥30%)評價方法的生物等效性評價指標,其單側95%置信區間上限應小于等于零,同時受試制劑與參比制劑的幾何均值比的點估計值應在80.00%-125.00%范圍內。
5. 其他考慮
本品為內源性藥物,FDA個藥指南建議從給藥前至少48小時到給藥后至少36小時控制受試者的飲食,并在飲食控制期間限制EPA的攝入。餐后試驗高脂餐應高脂、高熱量,但不含EPA。日常飲食中多種食物含有EPA,如海洋魚類、貝類、海洋魚油及其制品等,試驗過程中飲食管理是本品等效的因素之一。
二十碳五烯酸乙酯作為首個經高質量循證證據證實可降低心血管風險的降TG藥物,打破了既往血脂管理“唯LDL-C”的觀念。《中國血脂管理指南》(2023年)基于循證結果也積極推薦二十碳五烯酸乙酯軟膠囊用于ASCVD伴TG升高(>2.3 mmol/L)的患者以降低ASCVD風險。
因其高變異、長半衰期、內源性等問題,對方案設計和試驗過程中的管控提出了高要求。如何篩選適宜的受試者有效降低基礎EPA水平對結果的干擾;避免食源性EPA攝入影響入血量;較長的采血期和清洗期如何提高受試者依從性;生物樣本檢測需排除基質干擾,提高回收率等。
作為國內早期進行本品生物等效性研究的CRO,我司在受試者儲備招募、試驗方案設計、試驗現場管理以及血漿樣本處理分析等方面均積累了豐富的經驗,正式試驗已取得等效結果,可助力申辦方快速推進二十碳五烯酸乙酯軟膠囊的BE研究。
[1]中國血脂管理指南,2023年。
[2]李勇,甘油三酯升高的心血管疾病高危患者應用高純度二十碳五烯酸制劑的臨床意義,中國循環雜志2022年11月第37卷第11期。
[3]FDA Draft Guidance on Icosapent Ethyl November 2022.
[4]J.-F. Lapointe et al, A Single-dose, Comparative Bioavailability Study of a Formulation containing OM3 as Phospholipid and Free fatty Acid to an Ethyl Ester Formulation in the Fasting and Fed States, Clinical Therapeutics January 30, 2019.
供稿:晶易醫藥解決方案部


